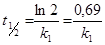SAASTEAINETE KÄITUMISEST KESKKONNAS
Kemikaali mõiste
2011. aastal kehtivas kemikaaliseaduses Veeseaduskäsitatakse kemikaalina ainet või valmistist, mis on kas looduslik või saadud tootmismenetluse teel.
Aine on kemikaaliseaduses defineeritud kui looduslik või tootmismenetluse teel saadud keemiline element või keemiline ühend koos püsivuse säilitamiseks vajalike ja tootmismenetlusest johtuvate lisanditega, välja arvatud lahustid, mida on võimalik ainest eraldada, mõjutamata aine püsivust või muutmata selle koostist.
Euroopa Parlamendi ja nõukogu 16. detsembri 2008 määruses nr 1272/2008, mis käsitleb ainete ja segude klassifitseerimist, märgistamist ja pakendamist ning millega muudetakse direktiive 67/548/EMÜ ja 1999/45/EÜ ja tunnistatakse need kehtetuks ning muudetakse määrust (EÜ) nr 1907/2006, on kasutusele võetud mõiste „segu”, mis on samas tähenduses nagu senini õigusaktides kasutatud mõiste “valmistis”. Segu on määratletud kui kahest või enamast ainest koosnev segu või lahus.
Kemikaal identifitseeritakse aine nimetuse ja Euroopa kaubanduslike keemiliste ainete loetelu (European Inventory of Existing Commercial Chemical Substances, EINECS) ja Euroopa uute keemiliste ainete loetelu (European List of Notified Chemical Substances, ELINCS) alusel või Chemical Abstracts Service’i (CAS) numbriga. Aine nimetus peab iseloomustama selle koostist ja struktuuri. Üldine ohtlike kemikaalide definitsioon esitatakse kemikaaliseaduses. Selle kohaselt on ohtlik kemikaal, mis oma omaduste tõttu võib kahjustada tervist, keskkonda või vara. Kemikaali ohtlikuks liigitamise alused on määratud eri õigusaktides, mida käsitletakse peatükis Reet.
Inimesed on tootnud rohkem kui 100 000 kemikaali, mida looduses tavapäraselt ei esine. Keskkonda sattudes muutuvad kemikaalid meid ohustavateks saasteaineteks. Samuti võivad inimestele ja muudele organismidele ohtlikuks osutuda loodusliku päritoluga ained. Oluline on teada, kuidas ained keskkonnas levivad, kas lagunevad või akumuleeruvad, ning kuidas nad mõjutavad inimese tervist ja ökosüsteemide toimimist.
Saasteainete levimine ja jaotumine keskkonnas
Et oleks võimalik ennustada kemikaalide mõju elusorganismidele ja ökosüsteemidele, peame oskama kirjeldada nähtusi, mis määravad saasteainete kontsentratsiooni eri keskkonnaosades ja organismides. Käesolevas peatükis tutvustatakse tähtsamaid orgaaniliste ainete levikut mõjutavaid protsesse ja neid määravaid ainete olulisemaid omadusi.
Saasteainete liikumine keskkonnas sõltub nii aine kui ka keskkonna omadustest. Ainete olulisemad omadused, mis määravad liikumise ja jaotumise keskkonnas, on:
- polaarsus (vees lahustuvus),
- aururõhk,
- molekulaarne stabiilsus.
Kriitilise tähtsusega keskkonnategurid on:
- temperatuur,
- tuule suund,
- õhuvoolude ringlus,
- pinnavete liikumine.
Saasteained on võimelised levima suurte vahemaade taha, ületades riikide ja kontinentide piire, tavaliselt toimub see vee ja õhu liikumise tulemusena. Näiteks kannavad jõed lahustunud või tahkes olekus aineid pinnavees edasi ja nii võivad need kuhjuda järvedes või estuaarides. Ookeanihoovused toimetavad aineid väga pikkade vahemaade taha. Kõik ained võivad edasi kanduda õhuvooludega, mis põhjustab nende sattumise vette või mullapinnale palju kaugemal saasteallikast.
Saasteainete levik atmosfääris sõltub paljudest teguritest, eelkõige meteoroloogilistest tingimustest, aga ka saasteallika asukohast ning seda ümbritsevast keskkonnast. Tuule suund ja kiirus, pilvisus, sademed, õhutemperatuur ja teised parameetrid mõjutavad oluliselt ainete levikut ning sisaldust atmosfääriõhus. Saasteained võivad õhus esineda auruna või assotsieeruda tahkete ainete või veetilgakestega. Kui ained on gaasilises olekus, siis on lisaks liikumisele koos õhuvooludega ainete edasikandjana tähtis roll difusioonil, näiteks nii satuvad freoonid atmosfääri osoonikihti. Loe saasteainete liikumisest lisaks ka peatükist Mailis
Samal ajal edasikandumisega võib toimuda keemiline muundumine, mille tulemusena saasteaine laguneb lihtsamateks, väiksema kahjuliku mõjuga ühenditeks või mõningatel juhtudel muutub saadusteks, mille puhul ilmneb sarnane või isegi suurem ökoloogiline ja tervist kahjustav toime. Et saasteaine avaldaks elusorganismidele mõju, peab ta neisse sisenema. Seda mõjutab saasteaine kättesaadavus ja kokkupuute viis. Neid tähtsaid aspekte käsitletakse selle õppematerjali peatükis Karin (link Karini peatükile) .
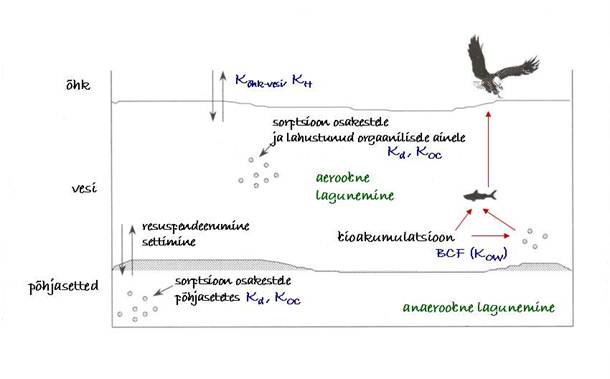
Ainete leviku kirjeldamise lihtsustamiseks jaotatakse keskkond osadeks ehk faasideks. Faas on keskkonnaosa, mida võib lugeda homogeenseks ja milles saasteaine käitub ühtemoodi. Nii võib atmosfääri või vett meres, jões või järves pidada üheks faasiks. Samuti võib lugeda faasiks mulda, veekogu põhjasetteid, taimestikku ja vee elusorganisme. Kuigi need faasid on sageli heterogeensed, võib saasteainete käitumise kirjeldamise ja modelleerimise lihtsustamiseks arvestada, et aine käitub faasi piires ühtemoodi ja on jaotunud selles ühtlaselt.
Keskkonda sattunud kemikaal jaotub kõikide nimetatud faaside vahel suuremal või vähemal määral erinevate füüsikaliste protsesside tulemusena. On kergesti arusaadav, et kemikaal saab jaotuda faaside vahel, mis on otsekontaktis (vt joonis 22). Kuigi vahetust ei saa toimuda faaside vahel, mis ei ole otsekontaktis, nagu näiteks kalad ja maismaataimestik, atmosfäär ja põhjasetted, saab kemikaal liikuda järk-järgult ühest faasist teise, nii et keskkonda sattunud kemikaal võib põhimõtteliselt jõuda keskkonna kõikidesse osadesse.
Vahetusprotsesse keskkonnaosade vahel võib iseloomustada kahefaasilistena, kusjuures olulisemad protsessid toimuvad järgmiste faaside vahel:
- atmosfäär-vesi,
- põhjasetted-vesi,
- elusorganismid-vesi,
- taimestik-atmosfäär,
- muld-atmosfäär.
Ainete tasakaalulist jaotust faaside vahel iseloomustab jaotuskoefitsient K12. Jaotusseaduse kohaselt on aine kontsentratsioonide suhe kahes tasakaalus olevas faasis antud temperatuuril püsiv suurus:
K12=C1/C2 (1)
Näiteks süsteemi õhk-vesi tasakaalu kirjeldab Henry seadus ja vastavat jaotus iseloomustab Henry konstant; tahke aine ja vee vahelist aine tasakaalulist jaotust iseloomustab jaotuskoefitsient Kd (vt joonis 22). Vajalikke jaotuskoefitsiente võib leida kirjandusest paljude ainete jaoks, need on määratud katsetes või arvutatud eri hindamismeetodeid kasutades. Kui jaotuskoefitsient on teada, võib aine kontsentratsiooni ühes faasis arvutada teises faasis teadaoleva kontsentratsiooni järgi.
Joonis 22. Saasteainetega keskkonnas toimuvad protsessid ja neid iseloomustavad jaotuskoefitsiendid
Ainete lahustuvus vees ja jaotuskoefitsient Kow Aine lahustuvus vees on väga oluline omadus, mis tugevalt mõjutab aine käitumist keskkonnas, tema liikuvust keskkonnas ja organismide vahel, samuti aine imendumist ja jaotumist organismides.
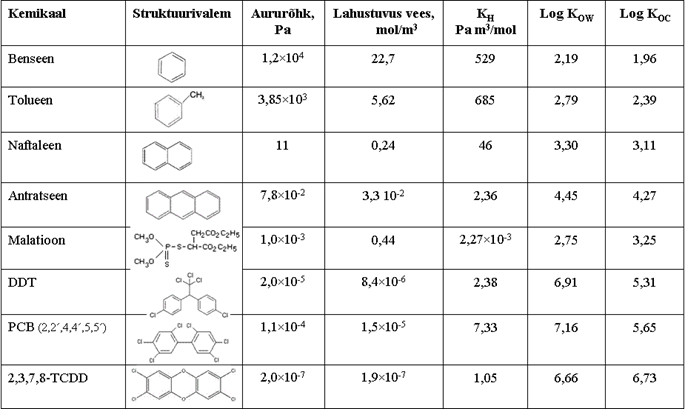
Vesi on polaarne vedelik. Hapniku aatom vee molekulis tõmbab elektrone vesiniku aatomitest rohkem enda poole ja selle tulemusena on hapniku aatom negatiivsemalt laetud kui vesiniku aatomid. Positiivse ja negatiivse laengu eraldatust molekulis iseloomustatakse kui polaarsust. Kuna vastasnimelised laengud tõmbuvad, tekib vees vesinikside vesiniku aatomite ja naabermolekuli hapniku aatomi vahel, nii ümbritseb iga vee molekuli neli vee molekuli . Erinevalt veest ei toimu näiteks mittearomaatsetes süsivesinikes positiivsete ja negatiivsete laengute jaotust ning sel juhul on tegemist mittepolaarsete ühenditega. Anorgaanilised soolad on vees lahustuvad, kuna katioonid ja anioonid on tugevas vastastoimes vastasnimeliselt laetud osaga vee molekulist. Samuti on vees suhteliselt hästi lahustuvad mitmed polaarsed orgaanilised ained, mis sisaldavad hapniku või lämmastiku aatomeid, nagu näiteks alkoholid ja amiinid. Kui palju ainet teatud tingimustel saab vees lahustuda, näitab lahustuvus. Aine lahustuvust võib defineerida kui aine maksimaalset hulka, mis lahustub puhtas vees tasakaalutingimustes kindlal temperatuuril. Kõik orgaanilised ained lahustuvad vees mõningal määral, kuigi mitmete ainete kontsentratsioonid vees võivad olla väga madalad, nagu näiteks DDT korral 8,4×10-6 mol/m3. Etanool on aga näide sellisest ainest, mis lahustub vees piiramatult. Näiteid orgaaniliste ainete vees lahustuvusest on toodud tabelis 4.
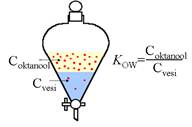
Ainete polaarsust või mittepolaarsust hinnatakse biokeemias ja keskkonnateadustes hüdrofoobsuse ehk lipofiilsusega. Erinevalt veest, mis on polaarne lahusti, on rasv mittepolaarne ja seetõttu kasutatakse aine mittepolaarsuse iseloomustamiseks mõistet hüdrofoobne (vett kartev) või lipofiilne (rasva armastav). Kui orgaanilisi vedelikke, nagu oktanool ja heksaan, mis ei lahustu vees olulisel määral, segada veega, tekib kahefaasiline süsteem, kus väiksema tihedusega vedelik jääb pinnale. Aine tasakaalulist jaotust eri faaside vahel iseloomustab joonis 23.
Joonis 23. Aine jaotumine kahefaasilises süsteemis oktanool-vesi ja jaotuskoefitsiendi KOW sisu
Enimkasutatav orgaaniline lahusti orgaaniliste ühendite keskkonnas jaotumise iseloomustamiseks on n-oktanool, kuna oktanool on struktuurilt sarnane amfifiilsetele ühenditele rakumembraanides. Amfifiilseteks nimetatakse ühendeid, milles on nii lipofiilne kui ka hüdrofiilne osa, nagu näiteks rakumembraanide koostises olevad fosfolipiidid. Oktanooli ja vee korral on jaotuskoefitsient avaldatav järgmiselt:
KOW = Coktanool/Cvesi (2)
kus KOW on oktanooli-vee jaotuskoefitsient, C oktanool ja C vesi on aine kontsentratsioonid vastavalt oktanoolis ja vees.
Jaotuskoefitsiendi KOW väärtus on suur vähepolaarsete ainete jaoks ja nii kasutatakse seda hüdrofoobsuse ehk lipofiilsuse hindamiseks. Teisisõnu, mida väiksem on vees lahustuvus, seda suurem on jaotuskoefitsiendi KOW väärtus. Kuna ainete kontsentratsioon oktanoolis ja vees võib olla väga erinev, siis jaotuskoefitsientide väärtused võivad ulatuda miljonitesse. Seetõttu kasutatakse sageli jaotuskoefitsiendi KOW logaritmitud väärtusi. Näiteid saasteainete KOW väärtuste kohta on esitatud tabelis 4.
Jaotuskoefitsient KOW mõõdab aine lipofiilsust, seega on võtmeparameetriks hindamaks aine käitumist keskkonnas. KOW väärtust kasutatakse saasteainete keskkonnas jaotumise iseloomustamiseks ja bioakumuleeruvuse hindamiseks.
Saasteainete jaotumine keskkonna eri osade vahel
Mitmed neutraalsed orgaanilised ained võivad aurustuda atmosfääri normaalsetes keskkonnatingimustes. Näiteks võivad sellisteks aineteks olla mitmed tuntud saasteained, nagu DDT, dioksiinid, naftakemikaalid. Vedeliku või tahke aine lenduvust iseloomustab aururõhk. Aururõhku defineeritakse kui rõhku, mida põhjustab aine aur, mis on tasakaalus vedeliku või tahke ainega. Aururõhk suureneb temperatuuri tõustes. Näiteid ainete aururõhkude kohta leiab tabelist 4.
Samamoodi nagu ained jaotuvad segunematute vedelike vahel, jaotuvad nad keskkonnas eri osade – vee, põhjasetete või mulla ja õhu ning elusorganismide vahel. Samuti saab jaotumist tasakaalu püstitumisel iseloomustada jaotuskoefitsientidega.
Ainete jaotumine: õhk-vesi Näiteks seda, kuidas on ühend jaotunud gaasifaasi ja sellega kontaktis oleva veefaasi vahel, iseloomustab jaotuskoefitsient:
Kõhk-vesi : Kõhk-vesi =Cõhk/C vesi (3)
Cõhk ja Cvesi on aine kontsentratsioon vastavalt õhus ja vees. Lahjades lahustes kehtib Henry seadus, aine jaotust õhu ja vee vahel iseloomustab Henry konstant KH:
KH= p/ Cvesi (4)
kus p on aine osarõhk lahuse kohal (Pa), Cvesi on aine kontsentratsioon vees (mol/m3) ja KH on Henry konstant (Pa m3/mol). Jaotuskoefitsient on Henry konstant, mida saab iseloomustada dimensiooniga ja mis võib olla erinev sõltuvalt valitud ühikutest. Henry konstandi väärtus sõltub aine aururõhust (lenduvusest) ja lahustuvusest vees. Henry konstanti võib väljendada ka dimensioonita vormis, kui väljendame aine rõhku lahuse kohal kontsentratsioonina ühikutes mooli liitri kohta, saame dimensioonita Henry konstandi:
KDH =Kõhk-vesi = Cõhk/Cvesi (5).
Rakendades seadust pV=nRT ja asendades eelnevasse võrrandisse (5), saame KH ja KDH omavahelise suhte: KDH = KH /RT (6).
Henry konstantide väärtused orgaaniliste ainete kohta on toodud tabelis 4. KH madalad väärtused näitavad, et kontsentratsioonid vees on kõrgemad kontsentratsioonist atmosfääris.
Aine jaotumine: vesi-tahke aine (põhjasetted, muld)
Põhjasetete ja vee vaheline jaotuskoefitsient Kd on avaldatav järgmiselt:
Kd= Csete /Cvesi = fOC*CsOC/Cvesi= fOC *KOC (7)
kus Csete ,CsOC, Cvesi on saasteaine kontsentratsioon vastavalt setetes, setete orgaanilises süsinikus ja vees. fOC on orgaanilises aines seotud süsiniku fraktsioon setetes ja KOC on setete/vee jaotuskoefitsient vastavalt orgaanilise süsiniku järgi. Samamoodi saab iseloomustada saasteainete jaotumist vee ja mulla vahel. Mõne orgaanilise aine KOC väärtus on toodud tabelis 4.
On teada, et setetes ja mullas olev orgaaniline aine omab tugevat jõudu sorbeerida lipofiilseid ühendeid. Eeldatakse, et toimuvad sorptsiooni ja desorptsiooni protsessid ja kuna enamikul juhtudel on tegemist saasteainete suhteliselt madalate kontsentratsioonidega, võib neid protsesse pidada aine kontsentratsioonist lineaarselt sõltuvaks.
Orgaaniliste ühendite käitumine ning jaotumine tahke aine ja vee vahel sõltub suurel määral aine füüsikalis-keemilistest omadustest, esmajoones lahustuvusest (KOW), aururõhust ja keemilisest stabiilsusest.
Polaarsed mitteioonsed ained (hüdrofiilsed, väike KOW) lahustuvad vees hästi ja ainult vähesel määral sorbeeruvad tahke aine osakestele. Sellised ained liiguvad mullas (setetes) kergesti koos veega ja on kättesaadavad organismidele mullas (põhjasetetes). Kui saasteaine lahustub vees halvasti (kõrge KOW) ja on lipofiilne, siis tavaliselt sorbeerub tugevalt mullas (setetes) oleva orgaanilise aine ja saviosakeste pinnale ning vees on selle aine kontsentratsioon väga väike. Orgaaniliste ainete seondumine mullas või setetes tahke ainega vähendab nende liikuvust keskkonnas ja kättesaadavust organismidele. Seega lipofiilsed ühendid, millel on kõrged KOW ja KOC väärtused, on veega vähe leostuvad. KOC alusel ennustatakse ainete liikuvust keskkonnas, näiteks pestitsiidide liikuvust mullas. Aine jaotumine: vesi-elusorganismid (3.taseme pealkiri) Väga lihtsustatult võib ka elusorganismide ja vee vahelist jaotust kirjeldada sarnaselt eelnevate näidetega. Eeldades tasakaalu kala ja vee vahel: Kkala-vesi= Ckala/C vesi (8),
kus Kkala-vesi on kala ja vee vaheline jaotuskoefitsient, Ckala on saasteaine kontsentratsioon kalas ja Cvesi on saasteaine kontsentratsioon vees. Seda elusorganismi ja vee vahelist jaotuskoefitsienti tuntakse biokontsentratsiooni tegurina ja tähistatakse BCF.
Biokontsentratsiooni teguri teadmine on tähtis just veeorganismide puhul, sest nende elukeskkond – vesi – on olulisim orgaaniliste saasteainete allikas. Veeorganismide puhul on näidatud, et esineb tihe seos BCF ja aine lipofiilsuse vahel, seetõttu ainete bioakumulatsiooni elusorganismidesse on võimalik kvantitatiivselt hinnata Kow alusel. Seda juhul, kui saasteaine omastatakse ja eemaldatakse organismist peamiselt passiivse difusiooni teel ja saasteaine metabolism on väikse tähtsusega. Ainete BCF ja KOW vahelist seost kirjeldab üldiselt järgmine võrrand: log BCForganism =a log KOW + b (9).
Seos bioakumulatsiooni ja logKOW vahel tugineb analoogiale saasteaine jaotumisel kala lipiidide ja vee ning n-oktanooli ja vee vahel. Kui on tegemist mittepolaarsete saasteainetega, mis väga lipofiilsed, akumuleerub saasteaine veeorganismidesse ja aine kahjulik toime võib avalduda isegi juhul, kui kontsentratsiooni vees on väga madal.
Tabel 4. Orgaaniliste ainete füüsikalis-keemilisi omadusi
Saasteainete lagunemine keskkonnas
Keskkonnas võivad saasteained olla muutunud teisteks sarnaste struktuuride ja omadustega ühenditeks. Samuti võivad tekkida mitmed väiksema molekulmassiga produktid. Keskkonnas lagunemise tulemusena väheneb saasteaine kontsentratsioon, lisaks muutuvad ainete füüsikalis-keemilised omadused ja ka toksiline mõju elusorganismidele. Lagunemisprotsessid võivad toimuda abiootiliselt või biootiliselt mikroorganismide abil.
Keskkonda sattuvate ainetega reageerivad keskkonnas olevad peamised ained, nagu näiteks hapnik ja vesi, mis osalevad vastavalt oksüdatsiooni ja hüdrolüüsi reaktsioonides. Hüdrolüüs on reaktsioon veega, mille tulemusena esialgne aine laguneb mitmeks produktiks. Hüdrolüüsi tõttu võivad kergesti laguneda karboksüülhapete ja teiste orgaaniliste hapete estrid, amiidid, karbamaadid ja süsivesinike halogeenderivaadid. Hüdrolüüsi tulemusena tekivad polaarsed ühendid, mis on esialgsest ühendist vähem lipofiilsed ja vees paremini lahustuvad.
Oksüdatsioonireaktsioonid on eriti tähtsad atmosfääris. Ka oksüdatsioonireaktsioonide saadused sisaldavad hüdroksüül-, karbonüül- või teisi polaarseid rühmi, mille tulemusena suureneb polaarsus ja vees lahustuvus. Lisaks oksüdatsioonile võivad toimuda ka reduktsioonireaktsioonid. Need on olulisemad nitroühendite ja süsivesinike halogeenderivaatide muundamisel – dehalogeenimisel. Mitmed reaktsioonid keskkonnas on võimalikud valgusest saadava lisaenergia tõttu, sel juhul on tegemist fotokeemiliste reaktsioonidega.
Orgaaniliste ainete bioloogiline lagunemine (biolagunemine ehk biodegradatsioon) toimub tänu mikroorganismidele ja nende mitmekesisusele. Biolagunemine võib olla täielik, see tähendab, et lagunemise lõpp-produktideks on anorgaanilised ained,süsivesinike täieliku lagunemise ehk mineralisatsiooni korral CO2 ja H2O. Võib toimuda ka ainult primaarne lagunemine, kus esialgne aine kaob ja selle asemele tekib mõni muu stabiilne orgaaniline ühend. Primaarse lagunemise korral on tähtis meeles pidada, et tekkinud saadused ei pruugi alati olla keskkonnaohutumad. Biolagunemise toimumiseks on vajalik mikroorganismide ja sobivate keskkonnatingimuste, sageli ka ko-substraatide olemasolu. Biolagunemise efektiivsus sõltub suurel määral aine füüsikalis-keemilistest omadustest ja toksilisusest ning kontsentratsioonist. Võrreldes esialgsete lipofiilsete ühenditega on bioloogilise lagunemise saadused tavaliselt polaarsemad ja lahustuvad paremini vees, see võimaldab neid organismidest kergemini elimineerida ja väheneb bioakumulatsiooni oht.
Keskkonnas toimuva hindamiseks on eriti tähis lagunemis- ja muundumisprotsesside kineetika. Kiiresti lagunevad saasteained kõrvaldatakse keskkonnast kiiresti ning nende toime on lokaalne ja lühiajaline. Kui saasteaine kiiret lagunemist keskkonnas ei toimu, võib selle mõju avalduda suures ulatuses ja pika aja jooksul.
Tavaliselt võib keskkonnas toimuvaid protsesse käsitleda lihtsustatult kui esimest järku reaktsioone, kus reaktsiooni kiirus on võrdeline kontsentratsiooniga v=-dC/dt=k1C (10),
kus C on aine kontsentratsioon, t aeg ja k1 on esimest järku reaktsiooni kiiruskonstant (ühikuks aja pöördväärtus, d-1). Kui reaktsiooni jälgida ajavahemikus t=0 kuni t ja sellele vastavad aine kontsentratsioonid on C0 ja Ct, siis on võimalik integreerimise tulemusena saada võrrandi järgmine kuju: ln (C0/Ct) = -k1 t (11) või Ct=C0 e –kt (12).
Lagunemisreaktsioonide kiiruse iseloomustamiseks ehk siis saasteainete keskkonnas püsivuse hindamiseks kasutatakse sageli poolestusaega t1/2. Poolestusaeg (kasutusel ka mõiste ”poollagunemisaeg”) on aeg, mille jooksul reageerib pool algmomendil olemas olnud ainehulgast. Seega ajaks t= t 1/2 on järele jäänud pool aine esialgsest hulgast Ct = 0,5 C0 ja järelikult
Esimest järku reaktsioonide puhul ei olene poolestusaeg aine algkontsentratsioonist ja seega on konstantne antud lagunemisreaktsiooni jaoks teatud keskkonnatingimustes. Näiteid ainete poolestusaegade kohta õhus on toodud tabelis 5. Peab meeles pidama, et orgaaniliste ainete püsivust keskkonnas mõjutavad mitmed tegurid, nagu näiteks hapniku kontsentratsioon, pH ja temperatuur.
Stockholmi konventsiooni järgi saasteained, mille poolestusaeg õhus on pikem kui kaks päeva, levivad õhus olulisel määral ja on potentsiaalselt ohtlikud kauglevi silmas pidades. Võttes arvesse poolestusaegu klassifitseeritakse aineid vähepüsivateks, püsivateks ja väga püsivateks (vt kriteeriume Euroopa Komisjoni 15. märtsi 2011 määrust (EL) nr 253/2011, millega muudetakse XIII lisa Euroopa Parlamendi ja nõukogu määruses (EÜ) nr 1907/2006, mis käsitleb kemikaalide registreerimist, hindamist, autoriseerimist ja piiramist (REACH)).
Püsivate, see tähendab pika poolestusajaga, lipofiilsete saasteainete puhul võib toimuda biomagnifikatsioon maismaa või vee toiduahelates. Selle tulemusena kujuneb ainete kontsentratsioon eriti kõrgeks toiduahela tipus olevates organismides. Näitena võib tuua DDT, dieldriin, mitmed PCB isomeerid, 2,3,7,8-tetraklorodibenso-p-dioksiin (TCDD), metüülelavhõbe jt. Seda tüüpi ühendid on enamasti väga püsivad ka mullas. Nende ainete kohta saab rohkem lugeda peatükist Arvo (link Arvo peatükile) Vees lahustuvad ja biolagunevad ühendid tavaliselt ei bioakumuleeru.
Tabel 5. Orgaaniliste ainete troposfääris toimuvate oksüdatsioonireaktsioonide tüüpilised poolestusajad
| Orgaaniliste ühendite klassid | Poolestusaeg päevades |
|---|---|
| Alkaanid | 1- 10 |
| Alkoholid | 1-3 |
| Aromaatsed ühendid | 1-10 |
| Alkeenid | 0,06-1 |
| Klorofluorosüsivesinikud (freoonid) | 100-47000 |
Saasteaine keskkonnaohtlikkuse ja keemilise struktuuri vahelised seosed
Saasteainete keskkonnas käitumise ja keskkonnaohtlikkuse kirjeldamiseks on vaja palju andmeid, näiteks sorbtsioonivõime mullas ja setetes, bioakumuleeruvus organismides, biolagunduvus. Paljude ainete kohta neid andmeid pole ja seetõttu ei ole võimalik ka hinnata nendega seotud riski. Võttes arvesse kasutusel olevate kemikaalide tohutu suurt hulka, on kõikide vajalike andmete teadasaamine eksperimentaalsete uuringute tulemusena vähetõenäoline, nende väljaselgitamine on väga kallis ja töömahukas. Selleks, et saada andmeid suure hulga ainete kohta, on katsete tegemisele alternatiiviks omaduste ennustamine mudelite abil.
Ainete keskkonnaohtlike omaduste ennustamiseks kasutatakse kvantitatiivseid struktuuri-aktiivsuse sõltuvusi (QSAR) või kvantitatiivseid struktuuri-omaduste mudeleid (QSPR). Nendes mudelites ainete keemilist struktuuri korreleeritakse kvantitatiivselt uuritava omadusega, näiteks biolagundatavuse, bioakumuleeruvuse või toksilisusega.
QSAR mudelite kasutamisel eeldatakse, et aine omadused on seotud tema struktuuriga. Uuritav parameeter arvutatakse teiste parameetrite alusel, mis on lihtsamini eksperimentaalselt määratavad või kergesti arvutatavad keemilise struktuuri alusel. Lähteandmetena ennustusmudelites võib kasutada eri tüüpi parameetreid. Näiteks oktanooli-vee jaotuskoefitsient Kow on tähtis parameeter erinevate omaduste, nagu näiteks setete-vee jaotuse ja biokontsentratsiooni teguri ennustamisel. Saasteainete kantserogeensuse hindamise QSAR põhineb molekulaarsetel fragmentidel. Ka saasteainete biolagundatavust kirjeldavad mudelid baseeruvad sageli fragmentidel, kuid võivad põhineda ka rohkema arvu selliste parameetrite rakendamisel, mis seotud molekulide elektroonse struktuuriga. Väga levinud on molekulaardeskriptorite, nagu seda on näiteks molekulaarpindala või –ruumala, elektrostaatiliste - molekulides laengu jaotust iseloomustavate või kvantkeemiliste deskriptorite kasutamine QSAR seoste leidmisel, sest neid saab leida keemilise struktuuri alusel eksperimentaalseid uuringuid tegemata.
Kasutatud kirjandus Risk Assessment of Chemicals: An Introduction. Toimet. C.J. Van Leeuwen, J.L.M. Hermes. Kluwer Academic Publishers, 1996. D. Connell, P. Lam, B. Richardson, R. Wu. Introduction to Ecotoxicology, Blackwell Science Ltd., 1999.