Kemikaalide toksilise toime hindamine
Sissejuhatus
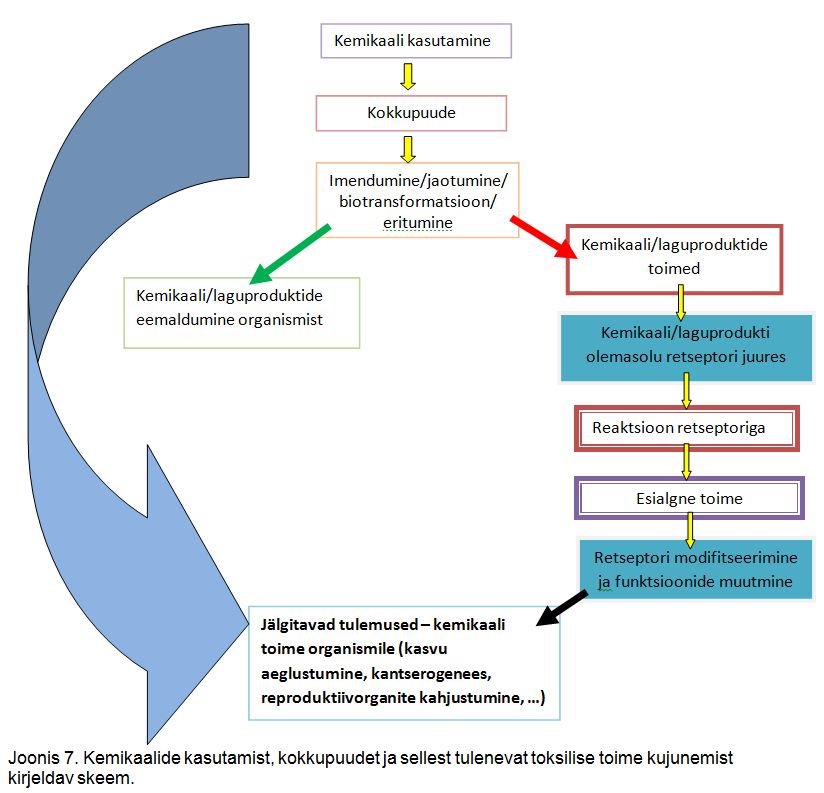
Kemikaalide laialdane kasutamine toob elustikule kaasa mitmeid ohte, sealhulgas võimalikke toksilisi toimeid. Kuidas tööstuslikult toodetud (aga ka loodusest hangitud) kemikaalid muutuvad elustikule toksilist toimet avaldavateks ohtlikeks saasteaineteks, on toksikoloogia seisukohast vaadeldav mitmeetapilise protsessina, mida on skemaatiliselt kujutatud joonisel 7.
Joonis 7. Kemikaalide kasutamist, elustikuga kokkupuudet ja sellest tulenevat toksilise toime kujunemist kirjeldav skeem
Joonisel 7 esitatud skeem on põhimõtteliselt kasutatav nii endogeensete (organismi normaalseks arenguks vajalike) kui ka eksogeensete ainete (organismi talituseks mittevajalike võõrainete) liikumise ja toimete jälgimiseks organismis. Kuna ökotoksikoloogias keskendume organismi normaalset talitust häirivatele ainetele, eelkõige toksilisi reaktsioone põhjustavatele kemikaalidele, siis endogeensete ainete problemaatikat käesolevas õppematerjalis ei käsitleta. Elustiku mis tahes vormide toksilise toime mehhanismides võib täheldada spetsiifilisi erisusi seoses elustiku väga ulatusliku diapasooniga – mikroorganismidest imetajateni. Sellegipoolest võime toimete uurimisel keskenduda kõige komplitseeritumas organismis – inimeses – toimuvate protsesside jälgimisele. Tagades kemikaalide kasutamisest tulenevate ohtude minimeerimise inimestele, võime üsna lootustandvalt vaadata ka elustiku kaitsele laiemas kontekstis – lihtsamatest eluvormidest keerukamateni.
Joonisel 7 on vasakpoolse noolega esile toodud kemikaalide toksilisuse põhjuse ja tagajärje paradoksaalne seos. Kuna pärast elustiku kokkupuudet kemikaaliga (põhjus) toimuvad protsessid, mis viivad toksilisuseni, kulgevad n-ö varjatult, organismi sees, siis tagajärg – toksiline toime – avaldub alles teatud aja pärast, kui kemikaal (või selle laguproduktid) on organismi kahjustavate tegevuste ahela kaudu sihtorgani tegevust mõjutanud. See muudabki kemikaalide toksiliste toimete uurimise keerukaks (milliseid protsesse siis kemikaal ikkagi organismis mõjutab?), rääkimata sellest, et ka bioloogiline materjal – elustik – võib kemikaalide toimele reageerida erinevalt isegi sama liigi piires.
Toodud skeemilt näeme, et kemikaalide kasutamine loob võimaluse nende kokkupuuteks elustikuga. Kuidas ja millal see aset leiab, sõltub väga paljudest asjaoludest.
Kemikaalide sattumine keskkonda lokaalsete avariide tagajärjel ning sellest tingitud kokkupuude elustiku mitmesuguste vormidega erineb mõnevõrra pideva foonilise saasteainete levikuga kaasnevast mõjust. Avariide korral on kokkupuute hindamine tavaliselt lihtsam, mis võib hõlbustada ka tagajärgede operatiivset ohjamist – juhul kui vajalikud vastuabinõud on põhjalikult läbi mõeldud ning omandatud. Keskkonnas saasteainetena levivate kemikaalide kokkupuudet elustikuga on märgatavalt raskem hinnata, veelgi keerulisem on saasteainete toksilisi toimeid kindlaks teha ja kontrolli alla saada.
Kui kemikaale kasutatakse ranges kooskõlas seadustes sätestatuga (nt REACH), peaks ohtlike kemikaalide sattumine keskkonda ja seega ka nende kokkupuude elustikuga olema praktiliselt ohututes piirides. Kui järjekindlalt aga õigusaktide nõudeid täidetakse ning nende täitmist kontrollitakse, sõltub inimfaktorist ja järelevalve tõhususest. Seega elustiku kaitse ohtlike kemikaalide toime eest ei sõltu pelgalt eeskujulikust seadusloomest ja seaduskuulekate kodanike tegevusest.
Elustiku kokkupuude kemikaalidega, selle hindamine Selleks, et hinnata elustiku kokkupuudet kemikaalidega (sh keskkonnas levivate saasteainetega), tuleb eelkõige arvesse võtta järgmisi tegureid: 1) kemikaali sattumine keskkonda ja selle keskkonna omadused (millistest allikatest ja millistes kogustes kemikaal keskkonda satub, kuidas toimub levik keskkonnas – ulatus, hajumine, kontsentratsioonid keskkonnaosades, levikut soodustavad ja pärssivad keskkonnafaktorid jpt); 2) kemikaali omadused (püsivus, bioakumuleeruvus, toksilisus – PBT (ik persistance, bioaccumulation, toxicity – PBT) ja kemikaali levikut mõjutavad omadused, näiteks lenduvus, lahustuvus, sorptsioonilised omadused).
Kemikaalidega kokkupuute erijuhud Lisaks keskkonnas avalduvale kemikaalide toimele, mis on põhjustatud kas avariidest, kemikaalide mittenõuetekohasest käitlemisest või tootmisprotsessides tekkivast heitmest, võib teatud juhtudel olla tegemist ka kemikaalide teadliku tarvitamisega – näiteks ravimite manustamine (inimeste või loomade ravi, aga ka suitsiidid) või sõjakemikaalide kasutamine (nt Agent Orange Vietnami sõjas). Ehkki sellised tegevused võivad toimuda nii positiivsetel (inimeste või loomade tervenemine) kui ka negatiivsetel (elustiku hävitamine või sandistamine) eesmärkidel, on kokkupuude kemikaalidega teadlikult planeeritud ja kindla otstarbega. Sõltuvalt kemikaalist ja selle kogusest (doosist) ning elustiku vastupanuvõimest võivad toksilised tagajärjed olla nii soovitud kui ka soovimatud. Käesolevas õppematerjalis elustiku kokkupuudet ravimitega põhjalikumalt ei käsitleta, sest ravimikemikaalide puhul on tegemist siiski spetsiifilise valdkonnaga, mida reguleerivad peale ohtlike kemikaalide käitlemist käsitlevate üldiste normatiivide ka ravimite tootmist, kasutamist ja ohutusnõuete järgimist puudutavad õigusaktid.
Kokkupuute klassifikatsioon kestuse alusel ja sellest tulenevad toksilised toimed Kemikaalide kokkupuutel elustikuga on olulise tähtsusega kemikaali kogus (kontsentratsioon elustikku ümbritsevas keskkonnas) ja kokkupuute aeg. Sõltuvalt kontakti ajast võib kokkupuudet toksikandiga klassifitseerida järgnevalt: a) akuutne kokkupuude – kontakt toksikandiga toimub lühiaegselt (maksimaalselt ööpäeva jooksul); b) subakuutne kokkupuude – korduvkontaktid toksikandiga kuni 1 kuu jooksul; c) subkrooniline kokkupuude – pidev kontakt kemikaaliga 1-3 kuu jooksul; d) krooniline kokkupuude – pidev kontakt toksikandiga kauem kui 3 kuu vältel.
Toksikandi kokkupuutele elustikuga järgneb toime, mida kokkupuute kestuse ja toime avaldumise alusel klassifitseeritakse tavaliselt kolme kategooriasse: a) akuutne (ehk äge) toksiline toime – tekib üldjuhul akuutse kokkupuute tagajärjel, kui toimiva toksikandi kogus on suur, ning avaldub enamasti lühikese aja jooksul pärast kokkupuudet; b) subakuutne (ehk alaäge) toksiline toime – väljendub tavaliselt aeglasemalt, ehkki toime võib olla sarnane akuutse toksilisuse toimega; c) krooniline toksiline toime – kujuneb välja pikema aja vältel ja tekib toksikandi väikese koguse kroonilisel kokkupuutel elustikuga pikema ajavahemiku jooksul.
Keskkonnas levivate saasteainete kokkupuute hindamine Sõltuvalt kemikaali toksilisusest käsitletakse ka kõiki kokkupuutejuhte erinevas skaalas. Kui vaadeldakse elustiku pidevat kokkupuudet ohtliku saasteainega, siis oluline parameeter, mille põhjal saab hinnata, kas kemikaali kontsentratsioon keskkonnas on ohtlik või ohutu,on kemikaali eeldatav kontsentratsioon keskkonnas (PEC - predicted environmental concentration), mida võrreldakse kemikaali lubatud piirkontsentratsiooniga (PNEC - Predicted No Effect Concentration), mis on toksikoloogiliste uuringute käigus kemikaalile määratud. Mõlemad olulised parameetrid määratakse metoodiliste juhendite alusel, kasutades selleks nii keskkonnaseire käigus mõõdetud tulemusi kui ka eksperimentaalseid andmeid kemikaalide toksilisuse uuringutest. Kui on teada, et kemikaali eeldatav kontsentratsioon keskkonnas on väiksem toksikoloogiliste uuringute põhjal kehtestatud kemikaali lubatud piirkontsentratsioonist (PEC < PNEC), võime teatud tõenäosusega väita, et kemikaal nendes konkreetsetes tingimustes ei ole elustikule ohtlik. Vastupidisel juhul (PEC > PNEC) tuleb aga leida võimalusi vähendada kemikaali kontsentratsiooni keskkonnas. Reaalsed olukorrad võivad olla palju keerukamad kui eespool kirjeldatud kahe parameetri võrdlemine (nt mitme kemikaali samaaegne esinemine keskkonnas, keskkonnatingimuste muutumine, toksilisuse uuringutel saadud uued andmed), seetõttu vajab toksiliste ohtude ja riskide hindamine pidevat järelevalvet, uue teabe hankimist, kemikaalide koosmõju uuringuid ja õigusaktide ajakohastamist vastavalt muutuvatele tingimustele.
Kemikaaliga kokkupuutele järgnevad protsessid Kui elustik on toksikandiga kokku puutunud, hakkavad kemikaaliga elustikus toimuma protsessid, mille kulgu (üksikuid etappe) ja tagajärgi ei saa visuaalsete meetoditega enamikul juhtudel jälgida, protsesside kohta saab informatsiooni vaid erilisi uuringuid ja analüüsimeetodeid kasutades. Ennetusabinõud kemikaalide toksiliste toimete avastamisel käivad käsikäes toksikoloogide kasutuses olevate uurimisvõimalustega.
René Truhaut (1909–1994, Prantsuse Teaduste Akadeemia tegevliige) võttis aastal 1969 kasutusele ökosüsteemidega seostuva toksikoloogia valdkonna tähistamiseks termini „ökotoksikoloogia“, mille määratles kui toksikoloogia haru, mis tegeleb ökosüsteemidele (loomastik, sh inimene, taimestik ja mikroorganismid) mõjuvate looduslike või sünteetiliste saasteainete toksiliste toimete uurimisega integreeritud kontekstis. Ta on kirjutanud: „Toksikoloogia võtmefiguurideks ei ole mitte praktiseerivad toksikoloogid, vaid keemikud, kes suudavad analüütiliselt täpselt avastada ja määrata toksiliste ainete kaduvväikseid koguseid, millel on toksikoloogias oluline tähtsus“. Siit tulenebki tänapäeva toksikoloogia üks olulisemaid arengusuundi – analüütilise keemia võimekuse suurenemine avastada ka nanomõõtmetes ja -kogustes kemikaale, mille toksilisi toimeid pole olnud võimalik varasemates uuringutes märgata. Samas liigub ühiskonna tehnoloogiline areng üha uute ja põnevamate omadustega kemikaalide väljatöötamise suunas, mis omakorda sunnib toksikoloogilisi uuringuid samuti suunduma üha uutesse valdkondadesse, näiteks nanotoksikoloogiasse.
Kemikaali toksilise toime tagajärjed võivad aga olla juba paljudel juhtudel märgatavad või diagnoositavad, näiteks lehtede kärbumine happevihma toimel, vähkkasvaja teke kantserogeense saasteaine toimel või taimede kasvu pidurdumine.
Selleks, et hakata uurima ohtliku kemikaali mõju elustiku normaalsele arengule, tuleb anda hinnang kokkupuute järel organismis toimuvatele protsessidele: • kemikaali sisenemisele organismi (imendumine, absorptsioon), • jaotumisele organismis (liikumine vere- ja lümfiringe kaudu eri organiteni), • biotransformatsioonile ehk metabolismile ning • kemikaali ja selle metaboliitide (laguproduktide) eritumisele organismist.
Nende nelja protsessi tähistamiseks kasutatakse eestikeelses kirjanduses akronüüme IJBE (imendumine, jaotumine, biotransformatsioon, eritumine) või IJME (imendumine, jaotumine, metabolism ja eritumine). Ingliskeelne enamkasutatud akronüüm IDBE on saadud terminitest „Intake“, „Distribution“, „Biotransformation“ ja „Excreation“. Jäädes toksikoloogia valdkonda, võime defineerida, et eespool loetletud protsessid on seotud ohtlike kemikaalide (võõrainete ehk toksikantide) liikumisega elustikus ja seda osa toksikoloogias nimetatakse toksikokineetikaks.
TOKSIKOKINEETIKA – kemikaalide liikumine organismis –– IJME
Ainete sisenemine organismi Toksikant võib organismi siseneda: • naha kaudu, • kopsude kaudu, • seedetrakti kaudu.
Kõige levinum viis toksikantide sattumiseks organismi on suu kaudu (peroraalselt), kus kemikaalil on esmalt kontakt mao ja soolestikuga. Seetõttu avalduvad esmased toksilised toimed maos ja soolestikus toimuvate protsesside häirumisega, eriti kui on tegemist toksikandi arvestatava kogusega.
Naha kaudu (transdermaalne) sisenemine organismi on toksikoloogias kõige väiksema tähtsusega ainete organismi sattumise mehhanism, kuid lipofiilsete vedelike korral sellise sisenemisviisi kaudu võib toksiline toime siiski väljenduda märkimisväärsete nahakahjustustena.
Kopsude kaudu sisenevad organismi eelkõige toksikandid, mis on gaasilises olekus, aga ka aerosooli, tahma või tolmuna saastatud õhus. Kopsude hea verevarustuse tõttu on võõrainete liikumine organismi teistesse organitesse eriti soodustatud.
Kemikaalide jaotumine organismis Pärast organismi sisenemist toksikant imendub (absorbeerub) biomembraane läbides üldisesse vereringesse, mis kannab ained mööda organismi laiali – seda faasi toksikokineetikas nimetatakse jaotumiseks ehk distributsiooniks.
Imetajate puhul on märkimisväärne, et toksikandid kasutavad organismis imendumisel samu biomembraane, mille kaudu rakkudesse sisenevad ka toitained. Kõige suurem osakaal imendumisprotsessides on difusioonil, mis võib kanda toksikandi läbi fosfolipiidse kaksikkihi organismi kõikidesse kudedesse ning rakkudesse.
Kemikaalide biotransformatsioon organismis Imendumisprotsessi käigus võib toksikantidega hakata toimuma ka juba kolmas toksikokineetiline protsess – metabolism ehk biotransformatsioon. Läbides biomembraane võivad toksikandiga aset leida mitmed muundumised, millega kaasneb uute ainete teke, mis omakorda võivad avaldad organismi talitusele positiivset või negatiivset toimet. Kui toksikandi metabolismiga kaasneb mittetoksiliste ainete teke, siis nimetatakse sellist protsessi detoksikatsiooniks. Tuntud on ka vastupidine metaboolse protsessi käik, kus ainetest, millel ei ole toksilist toimet, tekivad metabolismi käigus uued, toksilise toimega ained. Sellisel juhul võib organismi sisenenud ohutut kemikaali nimetada protoksikandiks ja protsessi, mis vallandab uute, toksiliste ühendite tekke, bioaktivatsiooniks ehk toksikatsiooniks. Võõrainete puhul on nendega organismis toimuvate protsesside kiirusel (kui kiiresti imendub, jaotub organismis, metaboliseerub) väga oluline tähtsus, sest toksilise toime avaldumine sõltubki resultandist – kas võõraine jõuab sihtorganini, mille funktsioone see aine saab toksiliselt mõjutada, või on toksikant imendumis- ja jaotumisprotsesside käigus teatud määral juba metaboliseerunud ning organile toimib väiksem kogus toksikanti, mistõttu ka avalduv toksiline toime on nõrgem.
Toksikandi ja selle metaboliitide eritumine organismist Need organismi sattunud toksikandid, mis on organismist uriini ja väljaheidetega kergesti eraldatavad, ei avalda samuti organismile niisama tugevat toksilist toimet kui eritumist ei oleks toimunud. Toksikantide eritumine (ekskretsioon) organismist võib toimuda järgmiste protsessidega: 1) neerude kaudu uriiniga; 2) maksa kaudu sapiga, mis sapipõie ja sapijuha kaudu voolab soolde; 3) soolestiku kaudu fekaalidega; 4) hingamisteede kaudu väljahingatava õhuga; 5) suu kaudu (oksendamine); 6) piimanäärmete kaudu; 7) pisaratega; 8) higiga. Toksikantide (aga ka nende toksiliste metaboliitide) eritumise viis sõltub suurel määral aine lahustuvusest vees (hüdrofiilsusest) ja rasvlahustuvusest (lipofiilsusest). Nii näiteks väljuvad uriiniga organismist vees lahustuvad ained, mille moolmass on väike. Mehhanismid, mille abil neerud aitavad aineid vereringest eemaldada, on väga spetsiifilised ja efektiivsed, sest neere läbib ca 25% arteriaalsest verest, mis on toksikandi transportimisel oluliseks võõrainete jaotusmehhanismiks.
Toksikantide migratsioon, püsivus ja bioakumulatsioon organismis Võõrained liiguvad organismis peamiselt vereringe kaudu, lümfiga transport on ebaoluline. Kõige suurem hulk verd läbib maksa, neerusid, aju ja nahka. Rasvkudedesse ja luudesse sattub toksikante verevarustuse tõttu hoopis vähem. Aine jaotumise seisukohalt on olulise tähtsusega biomembraanide omadused ja ainete seondumine kehavedelikes.
Organismi sisenenud võõrainete toksiliste toimete seisukohalt on aga suure tähtsusega selle aine poolestusaeg ehk pool-lagunemisaeg – aeg, mille jooksul pool organismi sisenenud aine kogusest kas lagundatakse, metaboliseeritakse või eritatakse.
Pika poolestusajaga ained, mille eritumine organismist ei toimu efektiivselt, võivad teatud kudedes bioakumuleeruda. Bioakumulatsiooni täheldatakse kõige enam rasvkoes, samuti luudes, maksa- või neerukoes. Bioakumulatsioon on seega tingitud aine lipofiilsusest ning aeglasest lagunemiskiirusest. Toksiliste ühendite bioakumulatsioon organismi eri kudedes võib kaasa tuua toksilisi toimeid, mis avalduvad pikema aja vältel. Bioakumuleeruvatel ainetel puudub akuutne toksiline toime, pigem on tagajärjeks krooniline toksikatsioon. Bioakumuleerunud toksikandi toime võib avalduda pikema aja möödumisel, tavaliselt siis, kui organismis toimuvad protsessid, mis selle aine kudedes ladestumist häirivad. Kui bioakumuleerunud aine, mis ladestumise kohas toksilist toimet ei avaldanud, hakkab vereringe kaudu liikuma teistesse organitesse, võivad sellega kaasneda toksilised toimed, mille algpõhjustele (kokkupuude kemikaaliga) jälile saamine võib olla väga keerukas. Organismides on ka kaitsebarjääre, mis takistavad võõrainete sattumist kõige olulisemate organiteni (nt aju), kuid need barjäärid ei ole selles mõtte absoluutsed, et teatud ained suudavad ka neid läbida, muutes toksikandi sisenemise, imendumise ja jaotumise ikkagi võimalikuks.
TOKSIKODÜNAAMIKA – kemikaalide toime organismi talitusele Kui võõraine on organismi sisenenud, seal vereringe kaudu jaotunud ning jõudnud sihtorganini, mille tegevusele sellel ainel on toksiline toime, siis esmalt toimub seostumine rakumembraani välispinnal asuvate retseptoritega. Kui aine on retseptorkompleksi membraanivälisele alale seondunud, liigub signaal retseptori muutumisest raku siseküljele ja käivitub rakusiseste biokeemiliste muundumiste jada, mille tagajärjel raku biokeemilised funktsioonid teisenevad. Toksikantide puhul on tegemist raku töö häirumisega ning toksilise toime avaldumine sõltub sellest, milline on toksikandi kogus ja kui ulatuslik on rakukoosluse häirumine. Protsess võib viia raku, seejärel tervete kudede, organi ja kogu organismi hävimiseni. Rakuretseptorite mõjutamise kaudu võivad häiruda näiteks rakuensüümid, teised rakusisesed molekulid (DNA, RNA) või samal rakumembraanil asuvad teised retseptorid. Kui toksiline toime on raku tasandil alanud, siis järgnevad toksilised ilmingud avalduvad juba sihtorgani talituse häiringuna. Keemiliste ühendite toksilise toime sihtorganiteks võivad olla nahk ja limaskestad, kopsud, maks, neerud, luuüdi, immuunsüsteem, närvisüsteem, kardiovaskulaarne ja reproduktiivne süsteem.
Kemikaali doos ja sellele vastav toime (organismi reaktsioon, reageering) (dose - response relationship) Millist toksilist toimet kemikaal sihtorganile või ka kogu organismi talitusele avaldab, sõltub lisaks aine toksilisusele (rakkude, kudede normaalse funktsioneerimise häiring) selle aine doosist.
Toksikoloogias on doos ehk annus organismiga vahetus kontaktis oleva bioloogiliselt aktiivse toksikandi kogus (grammides, milligrammides vms). Eristatakse välist ja absorbeerunud ehk sisemist doosi.
Välise doosi all mõeldakse toksikandi koguhulka, millel on kokkupuude organismiga (eksponeeritud doos). Doos, mis on sisenenud organismi ja hakkab organismis levima, kannab nimetust absorbeerunud ehk sisemine doos. Organismi seisukohalt on aga kõige olulisem see toksikandi kogus, mis asub kohas, kus see avaldab kahjulikku mõju. Seda toksikandi kogust võivad mõjutada jaotumisprotsessis toimuvad metaboolsed protsessid, mis vähendavad absorbeerunud doosi.
Aine reaalset jõudmist toksilise toime avaldumise paika organismis mõjutab seega biosaadavus. Biosaadavus on defineeritud välise doosi osana, mis transporditakse organismi sisenemise kohast üldisesse ringesse lähteühendi kujul. Kuna toksikoloogilistes uuringutes kasutatakse väga erinevaid testorganisme (mikroorganismidest hiirte, jäneste jt imetajateni), siis dooside võrdlemise hõlbustamiseks on kasutusele võetud toksikandi (uuritava kemikaali) kogus milligrammides (või grammides) testorganismi kehakaalu ühiku (nt kg) kohta – mg /kg BW (BW – body weight).
Toksiliste toimete uurimine Kemikaal võib esile kutsuda väga mitmesuguseid toksilisi toimeid. Kui tehakse katseid testorganismide uurimiseks toksikantide toime suhtes, siis on oluline kindlaks määrata, milliseid toksilisi toimeid uuritakse ja milliseid testorganisme kasutatakse, millistes dooside diapasoonis kemikaale kasutatakse ning millise kokkupuuteajaga (akuutse ja kroonilise toksilisuse testid) toksilisuse test läbi viiakse. Toksikoloogilistes testides fikseeritakse nimetatud tingimused võimalikult täpselt, et testide tulemused oleksid korratavad. Kuna testorganismid on bioloogilised objektid, siis suurim probleem toksikoloogilistes uuringutes on bioloogilise materjali heterogeensus ning sellest tulenev toksilise toime hajuvus.
Toksiliste toimete uurimise teste tehakse kahel eesmärgil: 1) sellise doosi (või aine kontsentratsiooni) määramine, mis ei avalda testorganismidele kahjulikku toimet (ohutute dooside leidmine); 2) sellise doosi (või aine kontsentratsiooni) määramine, mis põhjustab teatavat toimet (ravimite väljatöötamine).
Toksilisi toimeid võib käsitleda ka nii, et mõni neist on pöörduva iseloomuga (toksiline toime on lühiajaline ja täielik tervenemine võimalik), teised aga pöördumatu iseloomuga (pärast toksikandi mõju lakkamist organismi normaalne talitus ei taastu).
Pöörduva iseloomuga toksilised toimed esinevad tavaliselt väiksemate dooside, lühiajalise toime ja sageli ka rakendatava ravi tulemusel.
Toksilisuse uuringute tulemuste graafiline esitamine Toksilisuse uuringute tulemused väljendatakse graafiliselt, kus argumendiks on testis kasutatud kemikaali doosid, millele on testi käigus määratud vastavad toimed ehk millises ulatuses uuritud kemikaal mõjutas testorganismide elutegevust. Toksikoloogias kasutatavates testides võib mõju hinnata mis tahes elutegevust iseloomustava parameetri kaudu – liikuvus, kasvukiirus, paljunemine, mõne organi või ensüümi ala- või ületalitus jpt. Kõige lihtsamini on testides määratav elutegevuse lakkamine – surm. Paraku annavad need testid vähe teavet selle kohta, millist organit ja mil viisil kemikaal mõjutas, samuti toksilise toime mehhanismi kohta, seetõttu kasutatakse laialdaselt ka kõiki muid toksiliste toimete näitajaid.
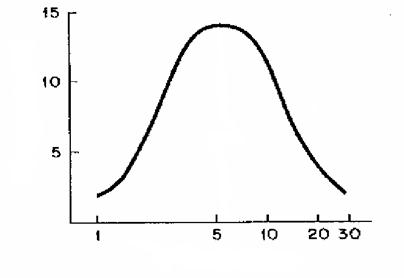
Testi tulemuste esitamisel kasutatakse kahte liiki graafikuid – sagedusgraafikuid ning kumulatiivseid graafikuid (vt joonised 8 ja 9). Mõlemat liiki graafikutel on abstsissteljel doos (mg/kgBW, mõnikord ka log skaalas), kuid sagedusgraafiku ordinaatteljel kajastatakse testorganismidele mõjunud toksilise toime kasvu protsentides iga testis kasutatud doosi korral, kumulatiivsel graafikul aga on kõikidel testis kasutatud doosidel esinenud organismide toksilised toimed summeeritud. Sageli on sagedusgraafik Gaussi kõvera kujuga, sest just selliselt toimivad toksikandid testorganismidele – madalatele ja kõrgetele doosidele reageerib tavaliselt väiksem hulk testorganisme, keskmistele doosidele (kontsentratsioonidele) põhiosa. Mida kitsamas dooside vahemikus sagedusgraafik asub, seda homogeensem on bioloogiline testmaterjal. Kui kõver on aga lame ning toimete väljendumise suurenemine hõlmab laia dooside vahemikku, on tegemist kas heterogeense testitava materjaliga või keerulise biokeemilise mehhanismiga, mis toksilise toimeni viib (vt joonis 8).
Joonis 8. Tüüpiline doosi - toksilise toime sagedusgraafik
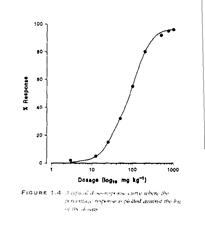
Kumulatiivne graafik (vt joonis 9) summeerib ordinaatteljel testis kasutatud doosidele vastavatele toksilistele toimetele reageerinud isendid, mis väljendatuna protsentides viib suuremate toksikandi dooside korral graafiku maksimumini – 100%-ni, sest toksikandile on alati võimalik leida selline doos, mis oma toksilise toime avaldab kõigi testorganismide suhtes (kui ei ole tegemist mõne eriti resistentse isendiga, mis on siis aga juba testorganismide ebakorrektsele ettevalmistamisele viitav asjaolu).
Joonis 9. Toksikolooglises põhitestis saadud doosi - toksilise toime enamlevinud kujuga kumulatiivse graafiku näide
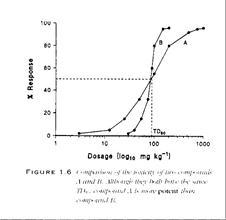
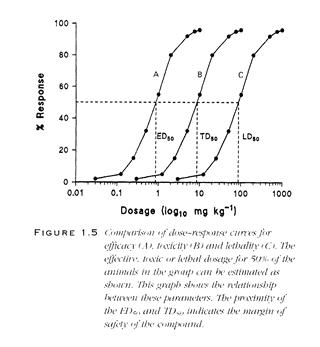
Toksikoloogilistes testide määratavad olulised parameetrid Põhiline toksikoloogiliste uuringute eesmärk on määrata kumulatiivsete graafikute kaudu toksikoloogia seiskohast kõige olulisemad parameetrid. Joonisel 9 on vastavate suuruste asukohad samade tähistega märgistatud: NOAEL (no-observed adverse effect level) – selline testitava kemikaali tase (mõnikord doos, vee-elustiku puhul tavaliselt toksikandi kontsentratsioon vees), mis ühelgi uuritaval testorganismil ei põhjustanud pöördumatut toksilist toimet. LOAEL (lowest observed adverse effect level) – kõige madalam testitava kemikaali tase (doos või kontsentratsioon), mis põhjustas testorganismil pöördumatu toksilise toime. Kuna letaalsete testide arv toksikantide uuringutes on siiski märkimisväärselt suur, siis sageli on teatmeteostes andmed just surmavate annuste (dooside), kontsentratsioonide või tasemete kohta. Et arvesse võtta bioloogilise materjali loomulikku heterogeensust, esitatakse tulemusena need näitajad, mis on surmavalt toiminud 50%-le testorganismidest (uuritava kemikaaliga kokku puutunud organismidest). Letaalseid parameeterid väljendatakse mõnel juhul ka väiksema (nt 10%, 20%) või suurema (80%, 90%) testorganismide hulga kohta. Tähistused on sel juhul järgmised: LC50 (lethal concentration for 50 % exposed organisms) – letaalne kontsentratsioon 50%-le kokkupuutes olnud testorganismile; LD50 (lethal dose for 50 % exposed organisms) – letaalne doos 50%-le kokkupuutes olnud testorganismile; TD50 (toxic dose for 50 % exposed organisms) – toksiline doos 50%-le kokkupuutes olnud testorganismile; ED50 (effective dose for 50 % exposed organisms) – efektiivne doos 50%-le kokkupuutes olnud testorganismile; LC90 (lethal dose for 90 % exposed organisms) – letaalne doos 90%-le kokkupuutes olnud testorganismile.
Toksiliste toimete uurimise testides saadud arvandmete avaldamisel lisatakse alati ka toksikandi manustamise viis ja testorganismi liik. See info on hädavajalik andmete kõrvutamiseks, sest muidu ei ole tulemused kuigivõrd võrreldavad. Järgnevas tabelis 1 on mõne tuntud kemikaali kohta esitatud LC50 väärtused, mis on saadud rottide testimisel ja neile toksikandi manustamisel peroraalselt (suu kaudu).
Tabel 1. Näiteid kemikaalide letaalse toksilisuse kohta (LC50), mis on saadud rottide testimisel, manustades neile vastavaid toksikante peroraalselt (suu kaudu) Keemiline ühend LD50 (mg/kg; rott, suu kaudu) Keemiline ühend LD50 (mg/kg; rott, suu kaudu) Etanool 10 000 DDT 100 Naatriumkloriid 4 000 Arseenik 48 Atratsiin 1 870 Dieldriin 40 Malatioon 1 200 Aflatoksiin B1 5 Lindaan 1 000 Strühniinsulfaat 2 Aspiriin 1 000 Nikotiin 1 Morfiinsulfaat 900 TCDD 0,001 Kofeiin 130 Botulismi toksiin 0,00001
Tabelist 1 saame ülevaate selle kohta, milliseid kemikaale võime lugeda suhteliselt madala toksilise toimega ühendite hulka ja milliseid mitte. Praegu teadaolevatest toksikantidest on kõige väiksem surmav annus botulismi toksiinil, mis võib tekkida toidus anaeroobse bakteri Clostridium botulinum elutegevuse tulemusel.
Toksilisuse klassifitseerimine akuutse toksilisuse testide põhjal Toksilisuse klassifikatsioon akuutse toksilisuse testides saadud tulemuste põhjal, mis on kirjanduse (Harrington, Gill) andmetel pakutud ühekordse doosi toimena 50%-le organismidest peroraalsel manustamisel, on esitatud tabelis 2.
Tabel 2. Toksilisuse klassifikatsioon LD50 väärtuste põhjal kirjanduse (Harrington, Gill, 1992) andmetel
Toksilisuse klass Toime kirjeldus, mis määrab aine kasutamisele esitatud ohutusnõuded LD50 – ühekordne doos kg kehamassi kohta peroraalsel manustamisel 1 Eriti toksilised < 1 mg 2 Väga toksilised 1 ÷ 50 mg 3 Mõõdukalt toksilised 50 ÷ 500 mg 4 Vähetoksilised 0,5 ÷ 5 g 5 Praktiliselt mittetoksilised 5 ÷ 15 g 6 Suhteliselt ohutud 15 g
Kumulatiivsete graafikute võrdlemine ja tõlgendamine
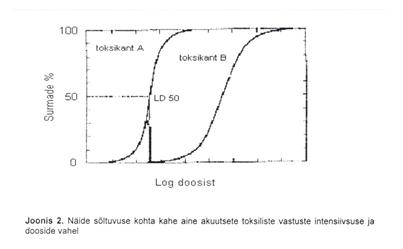
Joonistel 10 ja 11 on võrreldud kahe toksikandi (A ja B) letaalse toksilisuse testi kumulatiivseid graafikuid.
Joonis 10. Kahe toksikandi, A ja B kumulatiivsed doosi-toime graafikud, kui toksikantide LC50 väärtused on võrdsed, kuid graafikute tõusud lineaarses osas on erinevad Joonis 11. Kahe toksikandi, A ja B kumulatiivsed doosi-toime graafikud, kui toksikantide LC50 väärtused on erinevad, samuti on graafikute lineaarsete osade tõusud erinevad
Joonise 10 on esitatud kahe kemikaali, A ja B toksilisuse testi tulemused. Kemikaalide toksilised doosid TD50 on võrdsed, kuid toksikandi toksilist toimet põhjustanud annuste diapasoonid on erinevad, mistõttu näeme, et toksikandi B toime avaldub testorganismidele väga kitsas dooside vahemikus, toksikandi A puhul on toksilise toime avaldumine tunduvalt laiemas diapasoonis, mis annab informatsiooni selle kohta, et testorganismide vastuvõtlikkus toksikandi toimele on erinev. Joonisel 11 on esitatud samuti kahe kemikaali, A ja B kumulatiivse toksilise toime graafikud. Jooniselt on näha, et kemikaali A toksiline toime avaldub juba madalatel doosidel, seega toksikant A kuulub toksilisemate ühendite klassi. Toksikantide letaalsete dooside väärtused on väga erinevad, samuti ei ole toksikantide A ja B graafikud ühesuguse tõusuga nende lineaarses piirkonnas, mis viitab jälle toksilise toime erinevale hajuvusele testorganismide kaupa. Toksikant A on avaldanud toimet ca 64%-le isenditest väga kitsas toksikandi dooside vahemikus (nt 0,9 ÷ 1,4 mg/l), samas toksikandi B mõju, mis on toiminud samale hulgale (65%) testorganismidest, on märksa laiem (nt 0,5 ÷ 1,6 mg/l). Seega toksikant B mõjutab elustikku teatud erineva mehhanismiga, millele osa testorganisme on vastupidavamad, osa mitte, ning see muudabki graafiku tõusu lineaarses piirkonnas aeglasemaks (samuti saaksime toksikandile B lamedama kujuga sagedusgraafiku). Võrreldes sama kemikaali erinevaid toksilisi toimeid testides, kus on hinnatud samade testorganismide erinevaid reaktsioone, näeme, et toksikandi reaktsioon 50%-le testorganismidest suureneb järjekorras efektiivne doos < toksiline doos < letaalne doos (ED50< TD50< LD50, vt joonis 12). Efektiivse ja toksilise doosi väike erinevus viitab asjaolule, et kui on tegemist ravimi doseerimisega patsiendile (vaja on, et see toimiks), tuleb silmas pidada toksilise doosi võimalikku lähedust ning seetõttu ravimi kasutamisel järgida ohutuid koguseid. Selliste tulemustega testitud kemikaali toimete graafikud on esitatud joonisel 12.
Joonis 12. Sama aine doosi-toime kumulatiivsed graafikud eri testides, milles on uuritud erinevaid toksilisi toimeid, et määrata aine efektiivne doos, toksiline doos ning letaalne doos
Ökotoksikoloogilised testid läviväärtuseta kemikaalidega
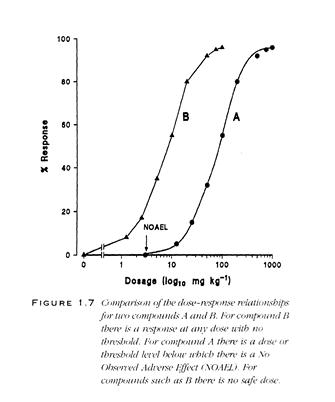
Ökotoksikoloogias olulise parameetri NOAEL leidmine toksikoloogiliste testide kaudu võib anda tulemuse, et leidub ka selliseid kemikaale, mille puhul mis tahes väikese annusega kaasneb pöördumatu toksiline toime. Näide sellise testi võimalikust tulemusest on esitatud kumulatiivse graafikuna joonisel 13, kus on toodud kahe toksikandi võrdlus – toksikandile A saab leida väärtuse NOAEL, toksikandile B aga mitte. Viimase kemikaali puhul kasutataksegi terminit „läviväärtuseta toksikant“, st toksilist toimet avaldab mis tahes kemikaali kogus.
Joonis 13. Ainete A ja B doosi-toime kumulatiivsed graafikud, mis näitavad ainete erinevust nende toksilise toime läviväärtuse poolest – aine A puhul saab graafikult leida doosi, mille puhul toksilist toimet ei esine, ainel B sellist doosi ei ole
Kemikaalide toimed organismile Toksilised toimed, mida kemikaalid võivad organismile avaldada, võib jagada sõltuvalt organismi või kudede kahjustuse iseloomust järgmiselt: 1) üldtoksiline toime – organismi üldine toksikoos; 2) düstroofiline toime – rakkude või kudede kahjustamine; 3) genotoksiline toime – geneetilise materjali (DNA, RNA) muutmine; 4) mutageenne toime – pöördumatute muudatuste esilekutsumine organismi pärilikkuse kandjates (kromosoomides, geenides); 5) kantserogeenne toime – pahaloomuliste kasvajate tekitamine; 6) gonadotroopne toime – sugurakkude kahjustamine (arengu pärssimine, hävitamine, muutmine mittetäisväärtuslikeks); 7) teratogeenne toime – embrüonaalsete häirete põhjustamine (loote väärarengud, defektid); 8) reproduktiivtoksiline toime – normaalsete järglaste saamist mõjutavad muutused organismis; 9) sensibiliseeriv toime – organismi muutmine mõne aine suhtes ülitundlikuks, mille tagajärjel tekivad allergilised reaktsioonid ja haigused. On ka kemikaale, mille toksiline toime tekitab samal ajal mitmeid kahjustusi. CLP-määrus (Classification, Labelling and Packaging) klassifitseerib ained spetsiifilise toime alusel inimese tervisele kantserogeenseteks, mutageenseteks ning reproduktiivtoksilisteks, jaotades eespool loetletud toksilised toimed üldisemasse skeemi. Organismi täisväärtuslikuks funktsioneerimiseks on vaja loomulikult vältida kõiki eespool loetletud toksilisi toimeid ning kasutada neid toimeid põhjustada võivaid kemikaale ohutul viisil. Erilist tähelepanu on viimastel aastatel pühendatud genotoksiliste ainete, kantserogeenide ning reproduktiivtoksilisust põhjustavate ainete avastamisele ja nende kasutamise vähendamisele. Vaatleme järgnevalt põhjalikumalt kantserogeensete ainete uuringutes tuvastatud toksiliste toimete ilminguid ning kantserogeneesi kui organismis pahaloomulise kasvaja väljakujunemise kulgu.
Kantserogeensus
Kantserogenees ehk pahaloomulise kasvaja teke on organismi reaktsioon kemikaali toimele, mis seisneb somaatiliste rakkude ebanormaalselt kiires ja kontrollimatus kasvus ja paljunemises. Arvatakse, et enamik pahaloomulisi kasvajaid on põhjustatud kemikaalidest, mida seetõttu nimetatakse kantserogeenideks ja mida nende teadaolevate rakusiseste interaktsioonide iseloomu tõttu omakorda klassifitseeritakse mitmesse rühma. Vaadeldes pahaloomuliste ehk vähkkasvajate teket (onkogeneesi) üldisemas plaanis, eristuvad selles üksteisele järgnevad etapid:
1) initsieerimine – raku kontakteerumine kantserogeeniga, mis põhjustab geneetilise muundusena DNA-adukti, millega on kasvaja initsieeritud. Protsess on pöördumatu ja selle tulemusel rakk muutub preneoplastiliseks;
2) transformeerumine – muundunud rakus aktiveeritakse onkogeen ning inaktiveeritakse supressorgeen. Raku apoptoosivõime alaneb. Raku replikatsiooni käigus eelmises etapis tekkinud geneetiline muutus kantakse üle uude rakku, mille tagajärjel tekib neoplastiline rakk;
3) promotsiooni etapil toimub tavaliselt korduvkontakt ainega, mis võimendab geeni ekspressiooni. Korduvkontaktid initsiaatoriga võivad anda kasvaja ka ilma promootorita, sellisel juhul tekib healoomuline kasvaja;
4) progresseerumise etapis võivad neoplastilised rakud muuta fenotüüpi ning muutuda pahaloomulisteks, kontrollimatult kasvavateks rakkudeks. Kujunebki välja vähkkasvaja.
Ajalooliselt olid nõgi ja kivisöetõrv esimesteks teadaolevateks kantserogeenideks juba 18. sajandil, kuna Inglismaal korstnapühkijate seas levinud munandikoti kasvajate põhjustajaks peeti nõe ja kivisöetõrva koostises olevaid aineid ja selline fataalne kutsehaigus ilmnes väga paljudel korstnapühkijatel, avaldudes kõige sagedamini nendel, kes olid seda ametit pidama hakanud noores eas.
Kõiki toksilisi kemikaale, tänapäeval eriti uusi väljatöötatud kemikaale testitakse kantserogeensuse suhtes, kasutades selleks mitmesuguseid testloomi. Testides saadud informatsiooni alusel liigitatakse kemikaalid rühmadesse.
Rahvusvahelise Vähiuuringute Agentuuri (IARC – International Agency for Research on Cancer) ettepanekul on kemikaalid kantserogeensuse põhjal jaotatud viide rühma, mis on esitatud tabelis 3.
Tabel 3. Kantserogeenide klassifikatsioon Rahvusvahelise Vähiuuringute Agentuuri järgi
| Tähis | Rühm | Info hulk kantserogeensuse kohta | Näiteid kemikaalidest |
|---|---|---|---|
| 1 | Kindel kantserogeen | Piisav inimese puhul | Arseen, aflatoksiin, benseen, östrogeenid, vinüülkloriid, tubakasuits |
| 2A | Tõenäoline kantserogeen | Piiratud inimese, piisav looma puhul | Bens(a)-antratseen, dietüülnitrososamiin, PCB-d, kaadmium |
| 2B | Võimalik kantserogeen | Piiratud inimese, ebapiisav looma puhul | TCDD, stüreen, uretaan, tetraklorometaan, heksaklorobenseen |
| 3 | Klassifitseerimata | Ebapiisav inimese ja looma puhul | Diasepaam, aniliin, dieldriin |
| 4 | Tõenäoliselt mitte kantserogeen | Ükski põhjalikest toksilisuse testidest ei näita kantserogeensust | Kaprolaktaam |
Euroopa Liidu CLP-määruse (Classification, Labelling and Packaging) alusel on kantserogeensed ained klassifitseeritud kolme kategooriasse, mille tunnused on määratud järgmiselt:
- kategooria kantserogeenid – ained, mis teadaolevalt on inimestele kantserogeensed ja mille kohta on piisavalt tõendeid, mis näitavad põhjuslikku seost inimese ainega kokkupuutumise ja pahaloomulise kasvaja tekke vahel;
- kategooria kantserogeenid – ained, mida tuleb käsitleda kui inimesele kantserogeenseid ja mille kohta on piisavalt tõendeid oletamaks, et inimese kokkupuude ainega võib põhjustada vähktõppe haigestumist. Tõendite allikana on ette nähtud pikaajalised loomkatsed ning muu asjakohane teave;
- kategooria kantserogeenid – ained, mis võivad inimese tervist kahjustada tõenäolise kantserogeense toime tõttu, kuid mille puhul olemasolev teave ei ole piisav põhjendatud hinnangu andmiseks. Nende ainete kohta on mõned loomkatsete käigus saadud tõendid, kuid need ei ole piisavad aine liigitamiseks 2. kategooriasse.
Analoogiline klassifikatsioon on sama määruse lisas kehtestatud ka mutageensete ainete jaotamisel kolme kategooriasse (1., 2. ja 3. kategooria mutageenid).
Reproduktiivtoksilisus
Reproduktiivtoksilisust põhjustavad ained on eespool nimetatud CLP-määruse alusel klassifitseeritud samuti kolme kategooriasse ja nende tunnused on määratud järgmiselt:
- kategooria reproduktiivtoksilised ained on need, mis teadaolevalt põhjustavad inimesel kas sigivus- või arenguhäireid;
- kategooria reproduktiivtoksiliste ainete hulka arvatakse need ained, mida tuleks käsitleda sigivus- või arenguhäirete põhjustajatena, sest selle kohta on piisavalt tõendeid, et nendel ainetel vastav toime eksisteerib (kas loomkatsetes saadud üheselt tõlgendatavate andmete põhjal või muu asjakohase teabe alusel);
- kategooria reproduktiivtoksilised ained on need, mis potentsiaalselt võivad olla kas sigivus- või arenguhäireid põhjustavad. Nende liigitamiseks teise kategooriasse on ebapiisavalt teavet, kuid loomkatsetes on saadud küllaldaselt tõendeid, et kahtlustada vastavaid aineid reproduktiivtoksilisuses.
Reproduktiivtoksilisuse valdkonnas on tehtud väga põhjalikke uuringuid, et hankida teavet võimalike reproduktiivtoksiliste ainete toime kohta. Ühendid, mille üldnimetuseks on endokriinsed häirijad (endocrine disruptors), võivad põhjustada häireid inimese ja loomade reproduktsioonisüsteemi toimimises. Kuna suurem osa endokriinseid häirijaid on saasteainetena sattunud meid ümbritsevasse keskkonda, seostatakse mitmete toksikantide toimet elustiku reproduktiivfunktsioonile just nende ühenditega. On kindlaks tehtud seosed mitmete paljunemisfunktsiooni mõjutavate organite häirumise ja organismide kokkupuute vahel selliste ühenditega nagu DDT, dioksiinid ja polüklooritud bifenüülid (PCB-d). Saastajate levik on põhjustatud inimtegevusest ja seetõttu on selliste saasteainete toime uurimine väga aktuaalne. On kirjeldatud, et need ühendid toimivad näiteks östrogeeni matkijana või esinevad antiöstrogeeni või antiandrogeenina. Hormonaalse tasakaalu rikkumine selliste ainete tõttu põhjustab organismis füsioloogilisi ja patoloogilisi häiringuid, mis viivadki reproduktiivtoksiliste tagajärgedeni.
Kemikaalide koostoime organismis
Enamik toksikoloogiauuringutest tehakse eksperimentaalselt konkreetsete kemikaalide toime väljaselgitamise eesmärgil. Selliseid steriilseid keskkonnatingimusi, kus organismile avaldab mõju vaid üks kemikaal, esineb praktikas väga harva. Tavaliselt on keskkonnas samal ajal mitu ainet ja seega ka elustik puutub kokku aineseguga, mis võib tekitada toksiliste toimete mitmesuguseid kombinatsioone. Kemikaalisegude summaarne toksiline toime võib väga palju erineda üksikute kemikaalide toimest. Järgnevalt on esitatud organismile samal ajal toimivate kemikaalide vastasmõjude ehk interaktsioonide võimalikud kombinatsioonid:
- aditiivne toime – seisneb kahe toksikandi samaaegses kokkupuutes organismiga ning kemikaalide toksilised toimed liituvad. Selline olukord ilmneb sageli siis, kui kemikaalide toksiliste toimete mehhanismid on sarnased;
- sünergeetiline toime – kahe samal ajal toimiva kemikaali koosmõju organismile on suurem, kui võiks olla nende toimete summaarne mõju. Seda kasutatakse mõnikord praktikas vajaliku toksikandi toime võimendamiseks (nt lisades insektitsiidile selle toksilist toimet suurendavat ainet);
- antagonistlik toime esineb juhtudel, kui samaaegselt organismile mõjuvate kemikaalide toime on väiksem, kui kummagi kemikaali eraldivõetuna toksilistest toimetest võiks eeldada. Sellisel juhul toimub ühe kemikaali toime inhibitsioon (toime pidurdamine) teise samal ajal organismiga kokkupuutes oleva kemikaali tõttu. Sellist toksilisuse vähenemise efekti kasutatakse mõnikord antidootide (ehk vastumürkide) väljatöötamisel. Antagonistliku toime biokeemilised mehhanismid võivad olla väga erinevad, näiteks funktsionaalne antagonism, mis tasakaalustab toksilisi toimeid, või keemiline antagonism – antagonist (üks kemikaalidest) reageerib teise toksikandiga ning produktil ei ole samaväärset toksilist toimet. Antagonistid võivad toimida ka retseptortasandil, pärssides kemikaali seostumist raku retseptoriga (retseptorantagonism), või muuta toksilise kemikaali võimet organismis imenduda (dispositsiooniline antagonism).
Keskkonnas on mitmesuguste saasteainete samaaegse leviku ning kokkupuute võimalusi väga palju, seega on toksikantide vastastoimete uurimine küllalt oluline võimalike võimendusefektide, aga ka antagonistlike või aditiivsete toimete tundmiseks. Kuna organismide mitmekesisus ja liigisisene heterogeensus keskkonnas on samuti nimetatud interaktsioone mõjutavad tegurid, võivad mõnel juhul olla toksikantide koosmõjul ettearvamatud tagajärjed.
Selle osa kirjandus: Püssa, Tõnu (2005), Toidutoksikoloogia, Eesti Põllumajandusülikool, Tartu Walker, C.H., et al (2001), Principles of Ecotoxicology, Taylor &Francis Timbrell, John (2003), Introduction to Toxicology, Taylor &Francis Harrington, J.M., Gill, F.S. (1992), Occupational Health, Oxford Internetist : Rene Truhaut (Wikipedia)